√70以上 価電子数 一覧 267280-価電子数 一覧
· このように炭素の場合は、最外殻電子数と価電子数が同じく4個です。 カルシウムは、このように最外殻電子数2個で価電子数が2個で同数です。 最外殻電子と価電子に違いが出るときは? しょうご ん? てことは、最外殻電子と価電子はほとんど同じじゃないか? という疑問ですが、大半問題2 次の化合物またはイオンについて各々の構造、錯体の価電子数(VEC)(有効原子番号 (EAN)),不対電子数と磁性について考察せよ。また,金属の形式的な酸化数を示せ。 (1) Co(NH 3) 63 5(2) Cr(NH 3) 63 (3) Zr(hC 5 H 5) 2 Cl 2 (4)24 酸化数と原子価 241 酸化数と原子価 243 遷移金属の酸化数と原子価 25 原子半径とイオン半径 251 原子半径 252 イオン半径 26 結合エネルギー 261 結合エネルギーの一般的傾向 3 イオン性-共有結合性 電気陰性度χの差が大きい= イオン性が強い(共有結合性が弱い) A H F Cl Br I

高校化学基礎 周期律と価電子 映像授業のtry It トライイット
価電子数 一覧
価電子数 一覧-正孔数:2 小熱により容易に価電子帯から電子が励起されて アクセプタ準位に上がる。そのとき価電子帯に作ら れた正孔が電界によって移動し、導電する。 正孔が多数キャリアとなる。 大熱・小熱の区別: 大きいエネルギーが必要な 過程は起こりにくい 自由電子 自由電子 正孔 正孔 正孔η5Cp 1価6電子供与配位子 η3Cp 1価4電子供与配位子 中性(0)= W(?) (1) (η5Cp) (1) (η3Cp) W(?)= 2価 → W(2)= d4 d4 6e (η5Cp) 4e (η3Cp) 2e (CO) x 2= 18e 例外1) d8 平面四配位錯体 (10族金属2価錯体) Cl 1価2電子供与配位子 CH2=CH2 0価2電子供与配位子
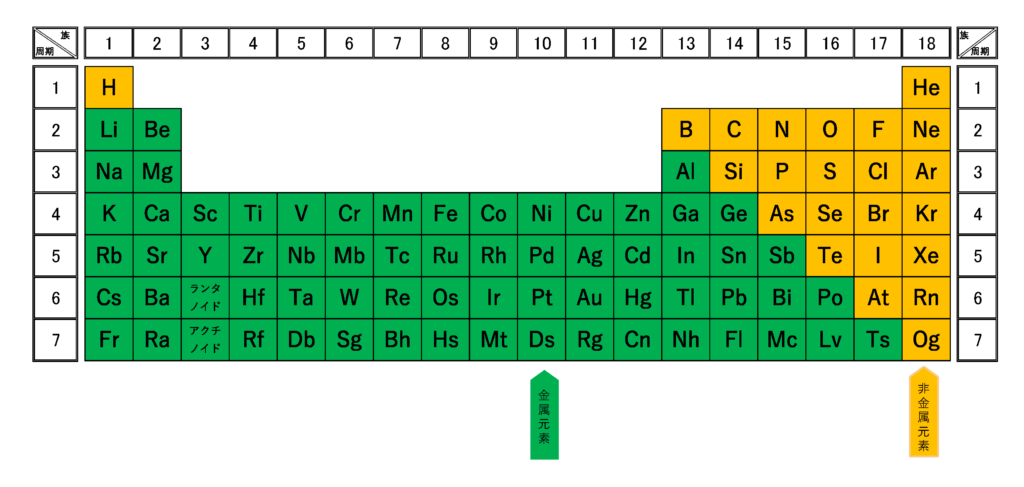



完全版 周期表の語呂合わせの覚え方と族 縦 や周期 横 の見方 サイエンスストック 高校化学をアニメーションで理解する
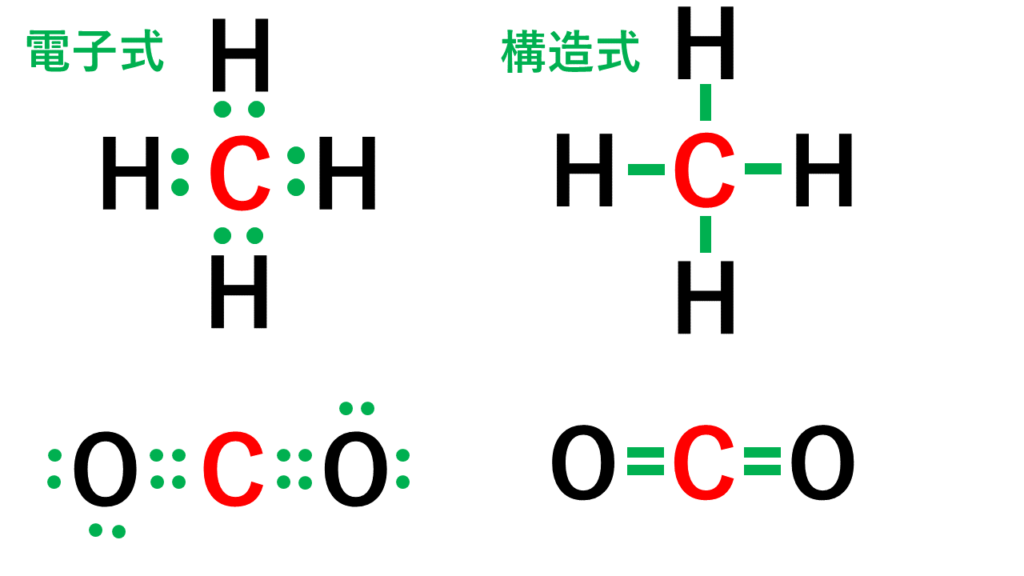
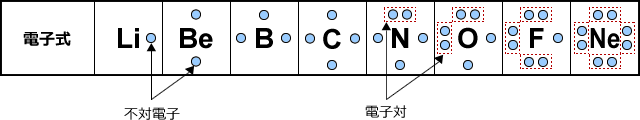
1.原子の構造 (ア)原子核 (イ)電子 (ウ)陽子 (エ)中性子 (オ)塩素 (カ)2(ク)7 (ケ)1 (コ)塩化 (サ)アルゴン(Ar) 2.電子配置 (1)ヘリウム He (2)炭素 C (3)酸素 O (4)マグネシウム Mg (5)ケイ素 Si 3.価電子3 ため、自由電子を表すとして、 係 数を( - )にとった。 y,z に 関 しても、同様の 扱 いを後で 行 う。 ( ) 2 ( ) 2 ( ) 1 2 2 2 2 2 2 2 x k x mE x mE x x x x x x x x x x x x φ φ φ φ φ =− =− · 例:炭素 価電子数が4つなので、すべて不対電子となります。 例えば、メタンCH 4 の場合、不対電子4つと水素が共有結合し、4本の共有結合が生じます。 炭素原子Cからは、価標(棒線)が4本出ています。 二酸化炭素CO 2 の場合、二重結合となりますが、同様に炭素原子Cからは、価標(棒線)が4本出ています。
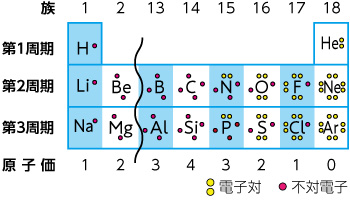
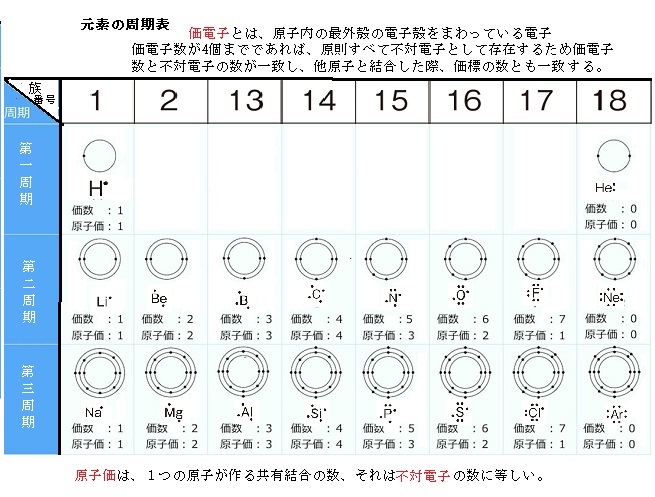
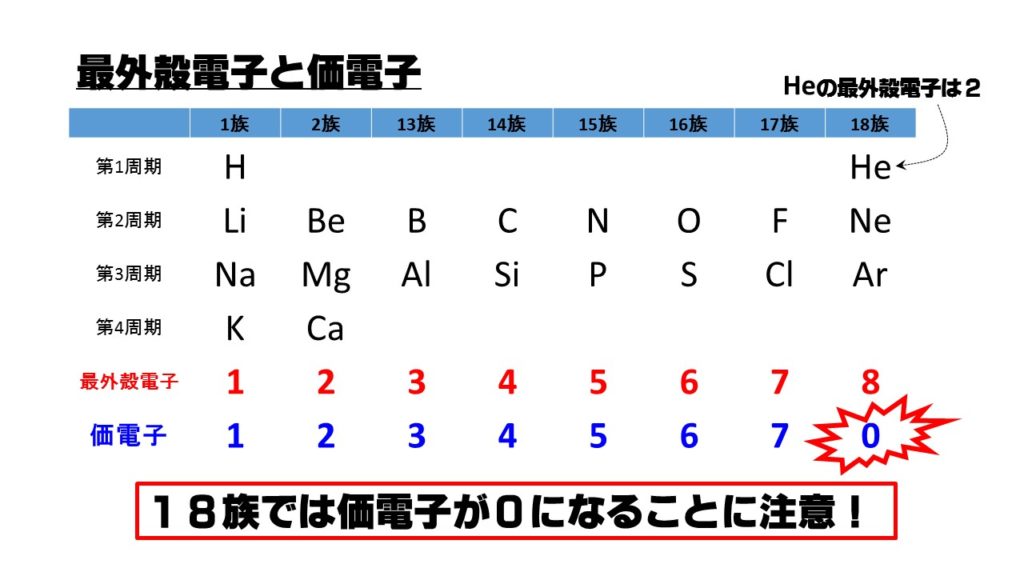
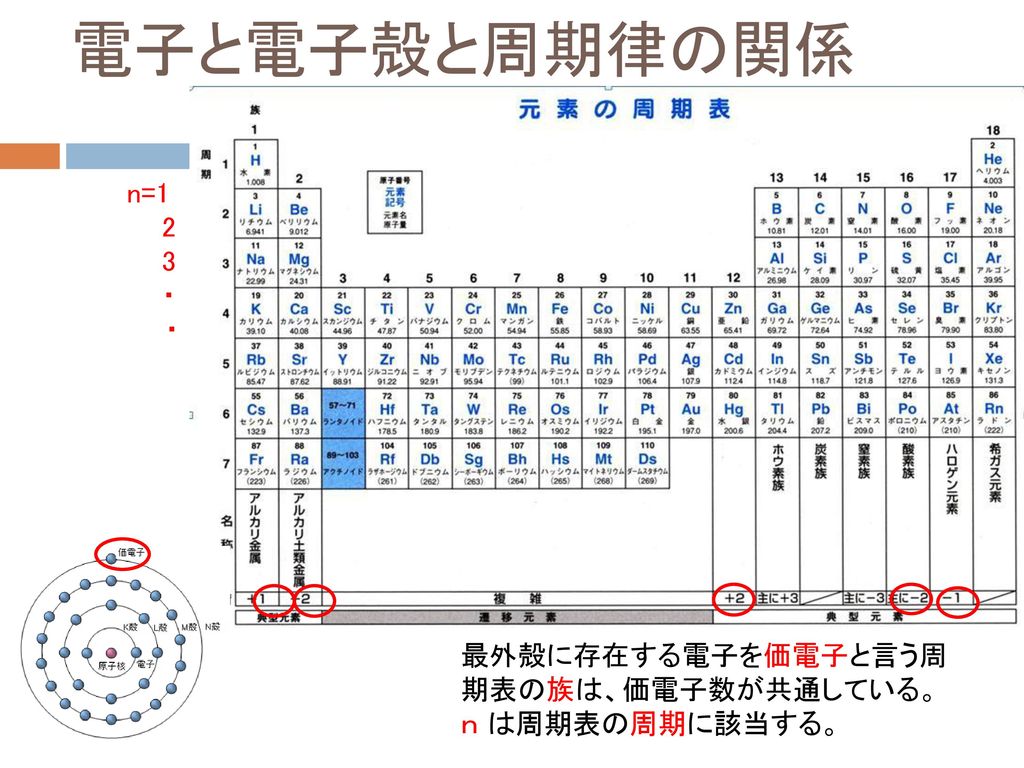
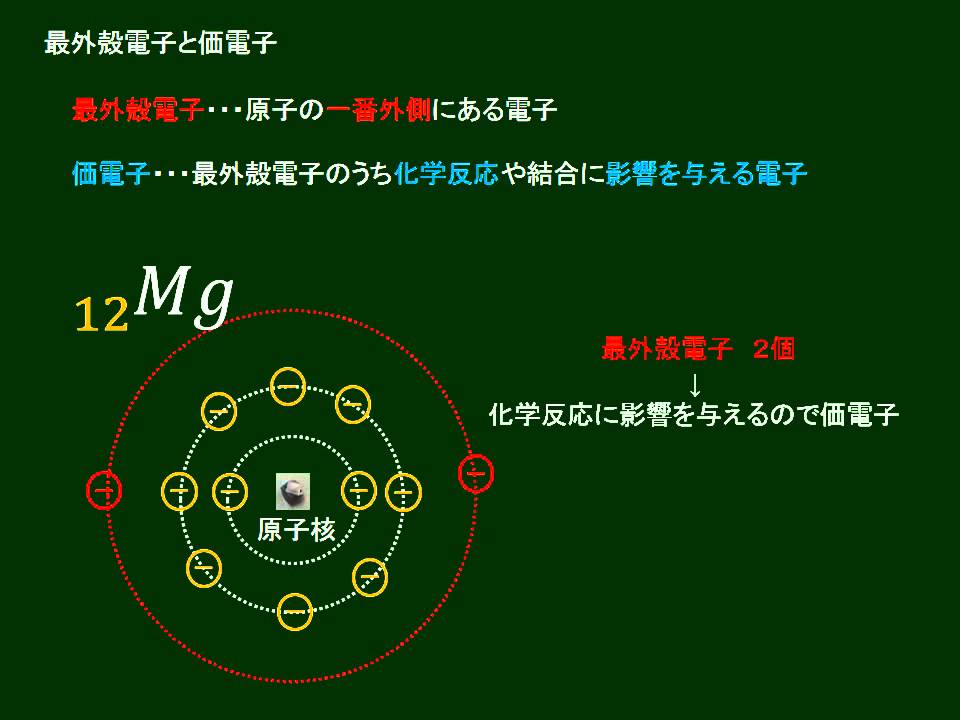
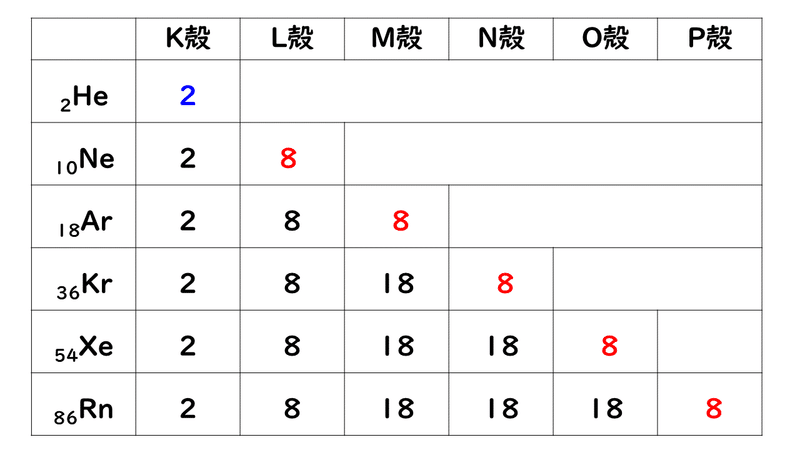
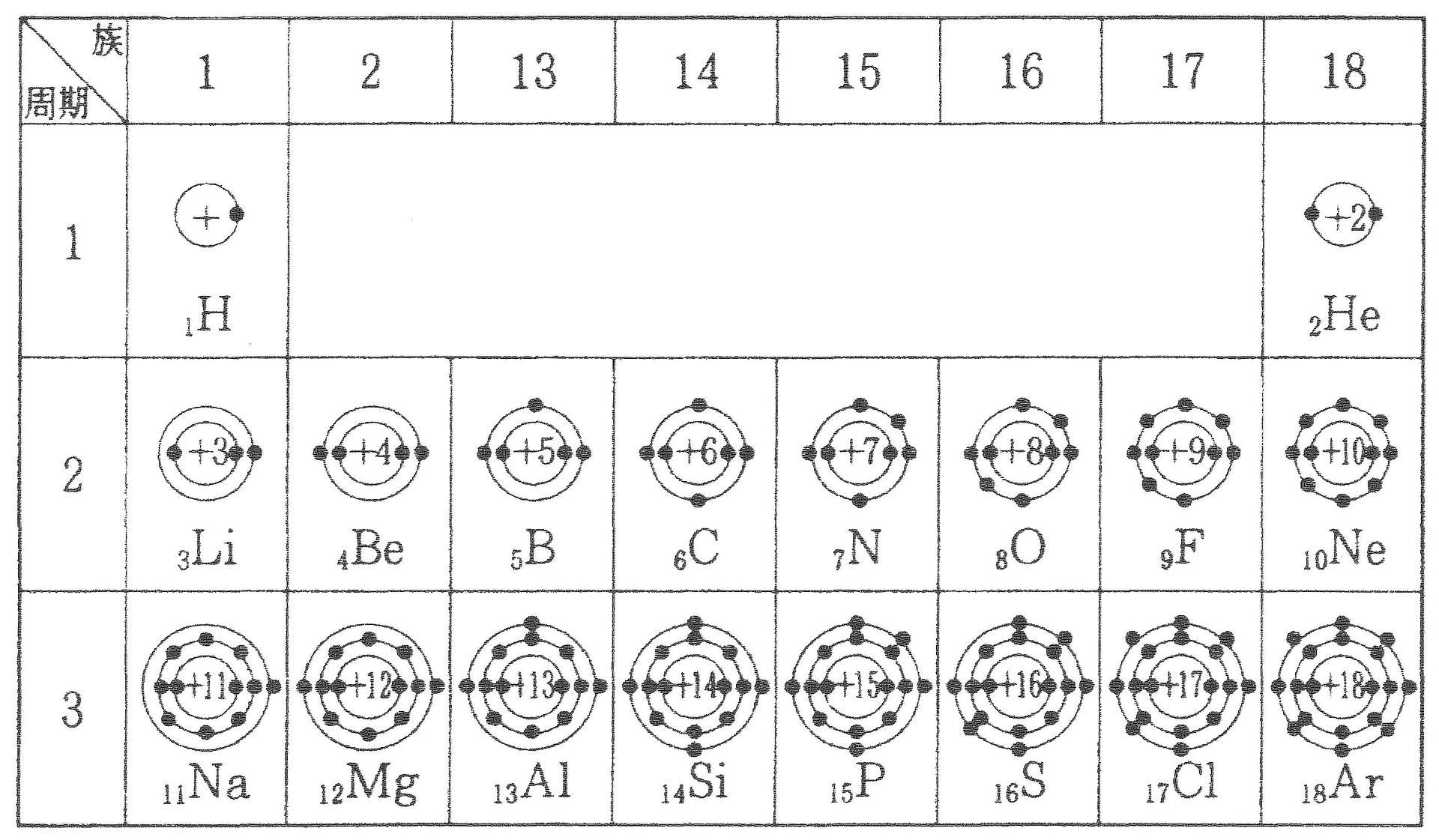
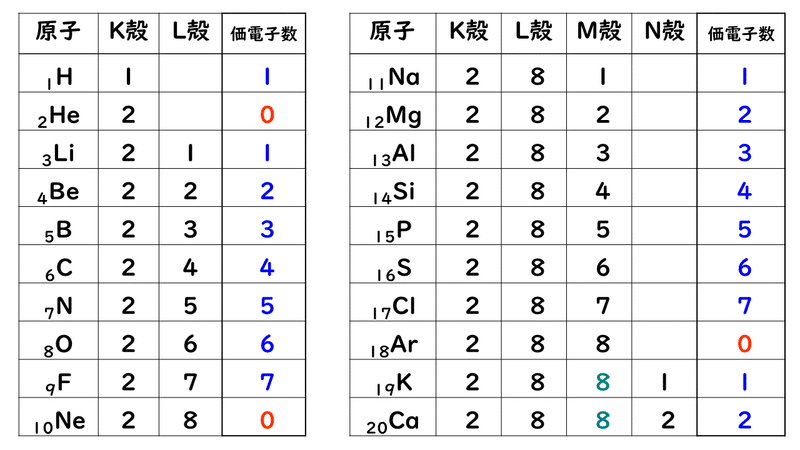
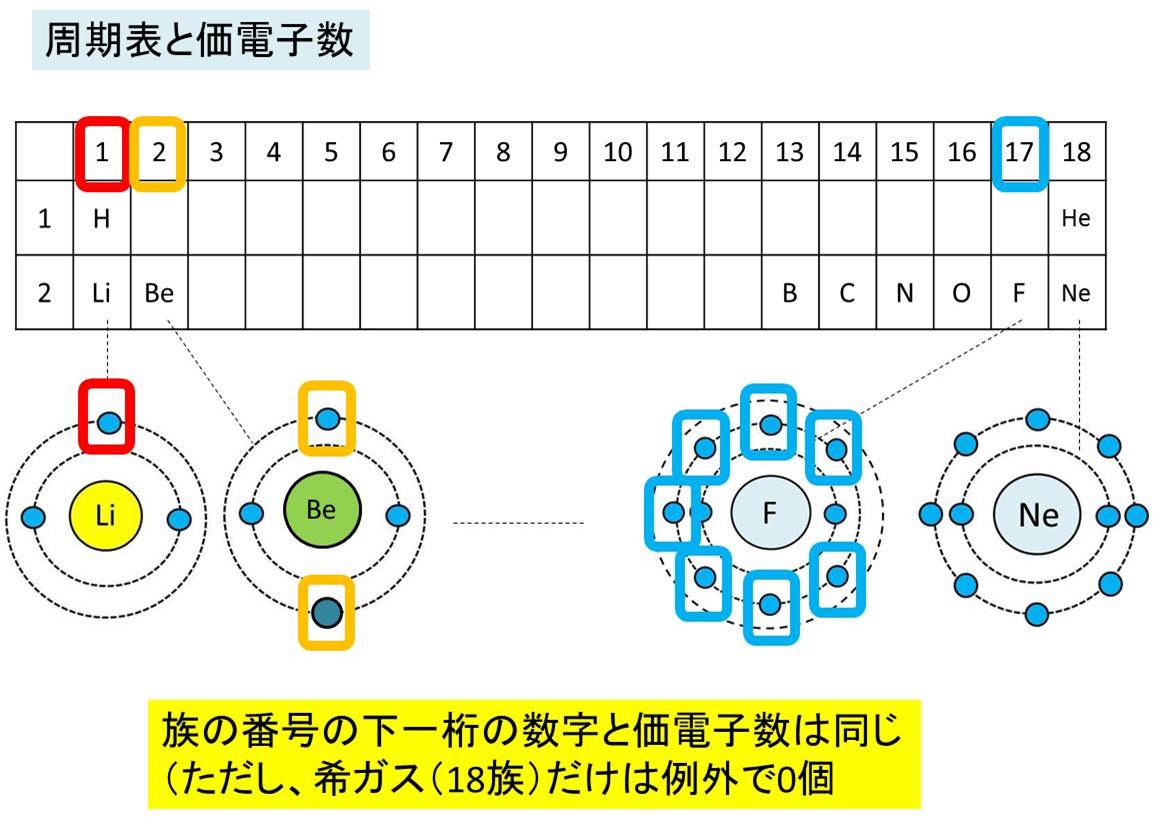
「価電子の数 = 最外殻電子の数」となる。 希ガス原子 0 とする。「価電子の数 ≠ 最外殻電子の数」となる。 窒素原子 7n とアルゴン原子 18 ar について,それぞれ次の問いに答えよ。 問1 k 殻,l 殻,m 殻には,電子がそれぞれ何個入っているか。 問2 価典型元素は第1 周期のHとHeを除いて,手の数が1~8 の原子を各周期に配列 してある。⇒ 元素の周期律(オクターブ説) 族番号 1 2 13 14 15 16 17 18 手の数 原子価 (8−5 )(8−6 8−7 8−8) ⤵ ⤵ ⤵ ⤵ (Heのみ手の数は2 ) 原子のモデル図 例 炭素Cの場合価電子とは、最外殻にある1~7個の電子のことでしたね。 ですから、左から順に、次のようになります。 1族 1 2族 2 13族 3 14族 4 15族 5 16族 6 17族 7 18族 0 希ガスの価電子の数が0 、ということに注
「原子番号 = 電子の数」 でしたよね? (これも大事なコツですよ!) 電子の数は、 「2個」で安定し、(※ 内側の軌道に 2個 ) 「10個」で安定し、(※ 内側に 2個 、2番目に 8個 ) 「18個」で安定します。(※ 3番目の軌道に 8個 ) 周期表で確認すると、・形式酸化数、価電子数 ・配位子と結合様式 ・18電子則 ・配位子場理論 ・JahnTeller 歪み ・錯体の幾何構造 1 有機金属錯体 有機金属錯体:金属-炭素結合を有する化合物 有機遷移金属錯体organotransition meal complex 遷移金属-炭素結合 主要族元素(maingroup element) アルキルリチウム、Grignard 反応剤電子構造の異方性を 考える必要がある。 電子数が偶数でも、 絶縁体 と 金属 に分かれる。 fcc、2価 (Ne/Nuc= 2): Ca, Sr, Ba fcc、4価 (Ne/Nuc = 4): Pb hcp、2価 (Ne/Nuc = 4): Be, Mg, Zn, Cd dia、 4価 (Ne/Nuc = 8): C, Si, Ge 金 属 絶縁体 (半導体) k (b) = 2, ¶ 0 E F E ª ß ¿ Ó



周期表バンザイ Icemsリサーチスコープ 京都大学アイセムス




原子価の意味と一覧 価電子 価標の違い Vicolla Magazine
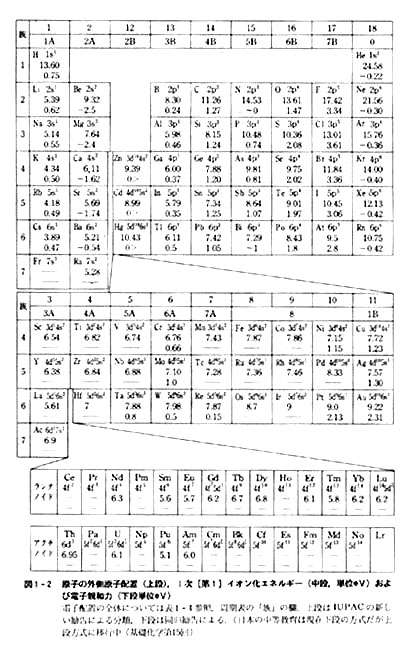
電子の有効質量はm e*,電子の有効質量はm h *で表わす 正孔 037 058 05 電子 055 040 008 Ge Si GaAs 有効質量m*/m 0 *各種半導体の有効質量の例 真性半導体のキャリア密度ni 不純物を含まない真性半導体においては,伝導電子と正 孔は対生成されるため総価電子数 = 42x6 = 16 2)共有結合の数(Nb)を計算する イオンの場合は電荷に応じて増(陰イオン) 減(陽イオン)する Nbc = (8x316)/2 = 4 n原子分子なら Ncb = (8nV)/2 水素をm個含むn原子分子なら Ncb Ncb = (8n2mV)/2 3)各元素を結合でつなぐ 電気陰性度の低い元素が中心にくる 3員環は作らない ルイス式軌道の最大収容電子数 軌道の種類 方位量子数 軌道の数 最大収容電子数 l 2l+1 2(2l+1) s01 2 p13 6 d25 10 f37 14 g 4 9 18 h511 22 i 6 13 26 電子殻の最大収容電子数 電子殻主量子数 軌道 最大収容電子数 n2n2 K 1 s 2=2・12 L 2 s,p 2+6=8=2・22 M 3 s,p,d 2+6+10=18=2・32 N 4 s,p�
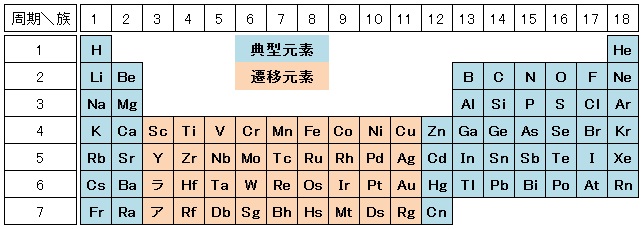



元素の分類 化学基礎 高校化学net参考書




高校理論化学 原子の電子配置 受験の月
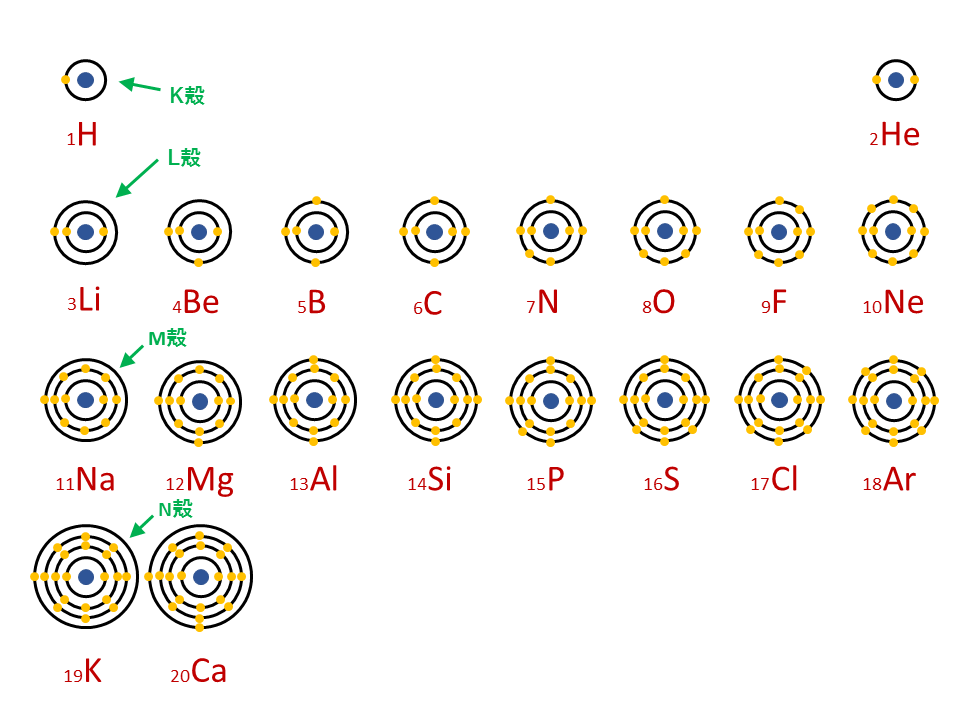
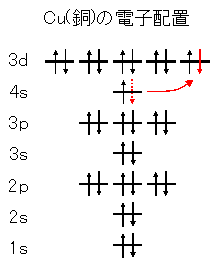
· 水素 \( _1 \mathrm H\) はK殻に1個の電子があり、価電子数は1です。 ヘリウム \( _2 \mathrm {He}\) はK殻に2個の電子がありますが、 K殻は2個で閉殻(満杯になる)しますので安定していて価電子とはいいません。 · クロムの価数について クロムは3、4,6価が存在するようですが、何どうなってそうなるのでしょう?クロムの原子番号24から最外殻電子は14?ではない・・・説明できる方ご教授ください。宜しくお願いいたしますm(__)m クロムの原子軌道はAr(3p)まで閉殻の後K,Caで4s軌道2価を埋めたのち3d軌道に4「価電子」 とは、 最外殻にある1から7個の電子 のことです。 「価電子」と「最外殻電子」はよく似ていますが、 「1から7個」 というところが非常に重要です。 今回のCとFの場合は、どちらも「1から7個」の中に収まっています。



1 5 イオンの生成 おのれー Note




価電子 Valence Electron Japaneseclass Jp
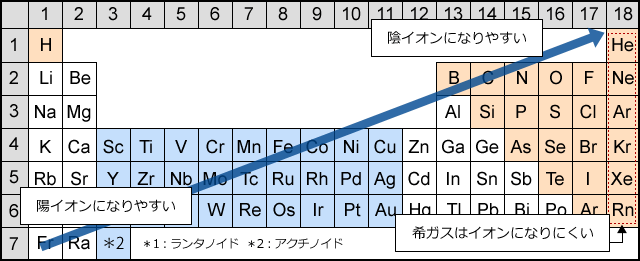
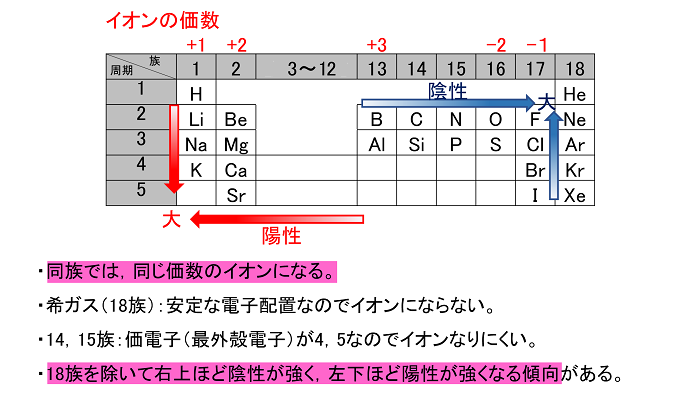
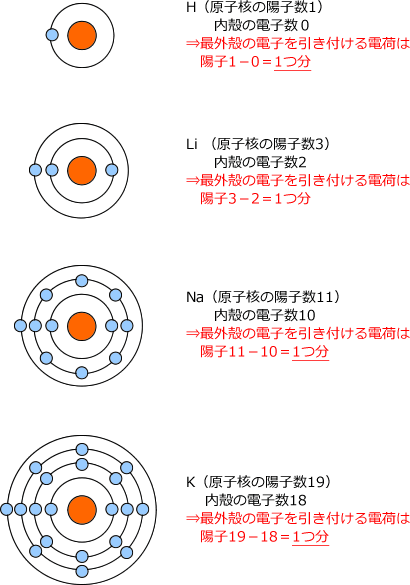
· 18族である希ガスの電子配置は安定的なため、そこに電子を一つや二つ加えただけの1族や2族は簡単に最外殻電子を1個または2個放出でき、一価の陽イオン(Na )や二価の陽イオン(Ca 2 )などになります。ン価電子数の求め方 族番号 = 価電子数 陰゜アル:価電子数に負電荷数を加える 陽゜アル:価電子数から正電荷数を引く ン例: CH 3NH 2の総価電子数 = 5×1 (H) 4 (C) 5 (N) = 14 e POCl3 の総価電子数 = 5 (P) 6 (O) 3×7 (Cl )= 32 e NO 3の総価電子数酸化数 d電子数 0 I II 2 3 4 5 6 7 8 18を超えない (18になると安定) (例外あり) 金属のd電子数 配位子からの電子 金属のd電子数と配位子からの電子数の和 金属のd電子数 配位子からの電子 金属のd電子数



Http Functfilm Es Hokudai Ac Jp Wp Content Uploads 17 02 Chemistry5 1 Pdf



車山高原レア メモリーが語る デモクリトスの原子論
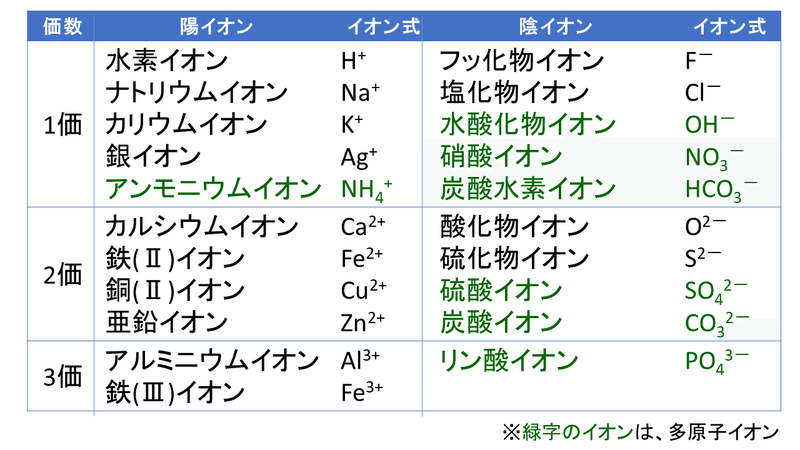
· 陽イオン・陰イオン 原子から電子が取れると 陽イオン に、原子が電子を取り込むと 陰イオン になる。 これらは、1コの原子からできたイオンなので 単原子イオン という。 陽イオン ナトリウムNaやカリウムKなどのアルカリ金属には、最外殻電子が1コ存在する。 この電子は、内側にある保存版最外殻電子・不対電子・原子価・価標の数一覧 18電子則(有効原子番号則) 金属のd電子数と配位子から供与される電子数 の合計(価電子数)が18のとき錯体は安定とな る経験則を18電子則という。これは、EAN (effective atomic number) 則*を簡略化したも のである。 が 「最外殻電子「価電子数」に関連した英語例文の一覧と使い方 Weblio英語例文検索 小窓モード プレミアム ログイン 設定 Weblio 辞書 > 英和辞典・和英辞典 > 価電子数の意味・解説 > 価電子数 に関連した英語例文 例文検索の条件設定 「カテゴリ」「情報源」を複数指定しての検索が可能になりました



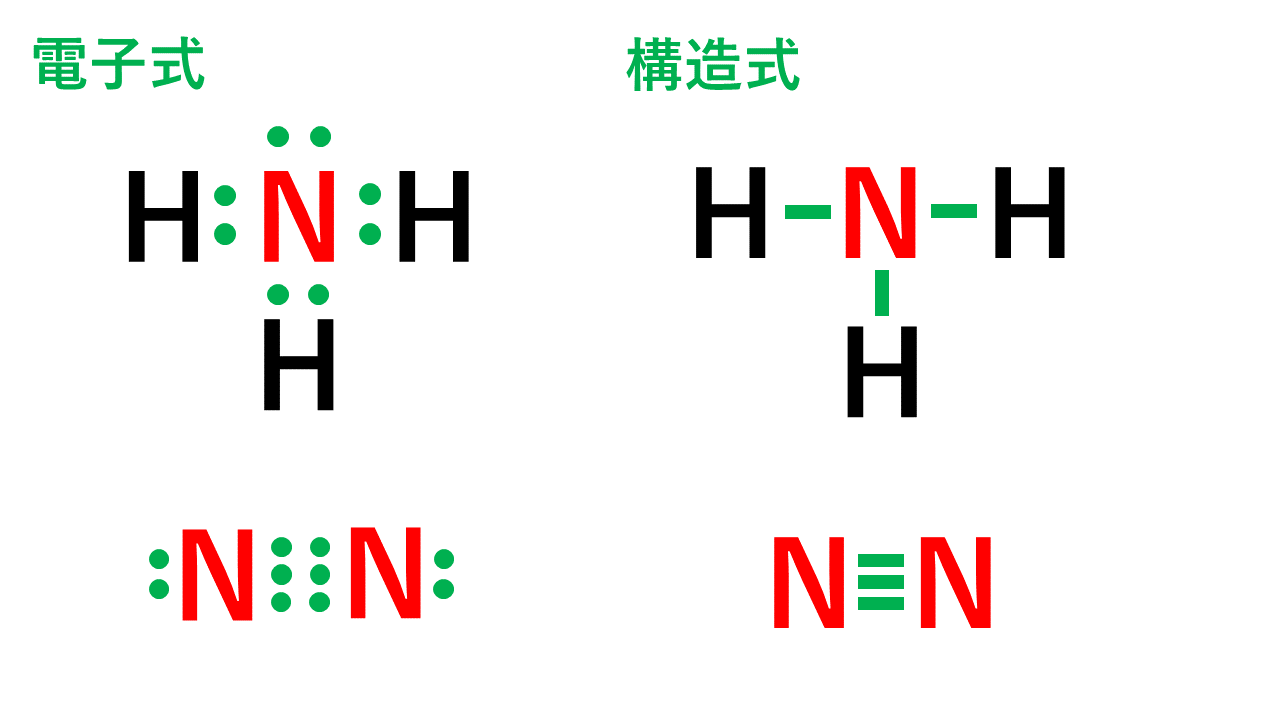
電子式の書き方と一覧 構造式と分子式の違い Vicolla Magazine




完全版 周期表の語呂合わせの覚え方と族 縦 や周期 横 の見方 サイエンスストック 高校化学をアニメーションで理解する
· それ故、ネオンのl殻にある8コの電子は、最外殻電子ではあるが価電子ではない。 ※価電子・最外殻電子について詳しくは最外殻電子と価電子(違い・一覧・8個の理由など)を参照 ※希ガスの電子配置について詳しくは希ガスの電子配置が安定な理由を参照②問題の電子が属するグループ内の他の各電子は035だけS に寄与する(1sは030) ③主量子数がnー1のグループの各電子は 085の寄与をする ④主量子数がnー2とそれ以下のグループの各電子の寄与は1 ⑤問題の電子が nd や nf の場合、③と④は成立せず、その=「原子価殻電子対反発理論」 静電反発 非共有電子対の間 >非共有電子対と共有電子対の間 >共有電子対の間 (二つの原子に跨る共有電子対は、電子の空間的広が りが広いので、電子密度が低く、静電反発力が小さい) sp混成軌道 sp2混成軌道 sp3混成軌道 授業計画 1回物質観の進歩と自然



2




価電子と最外殻電子の違いは なぜ一致しない 化学基礎の電子配置の求め方をわかりやすく説明
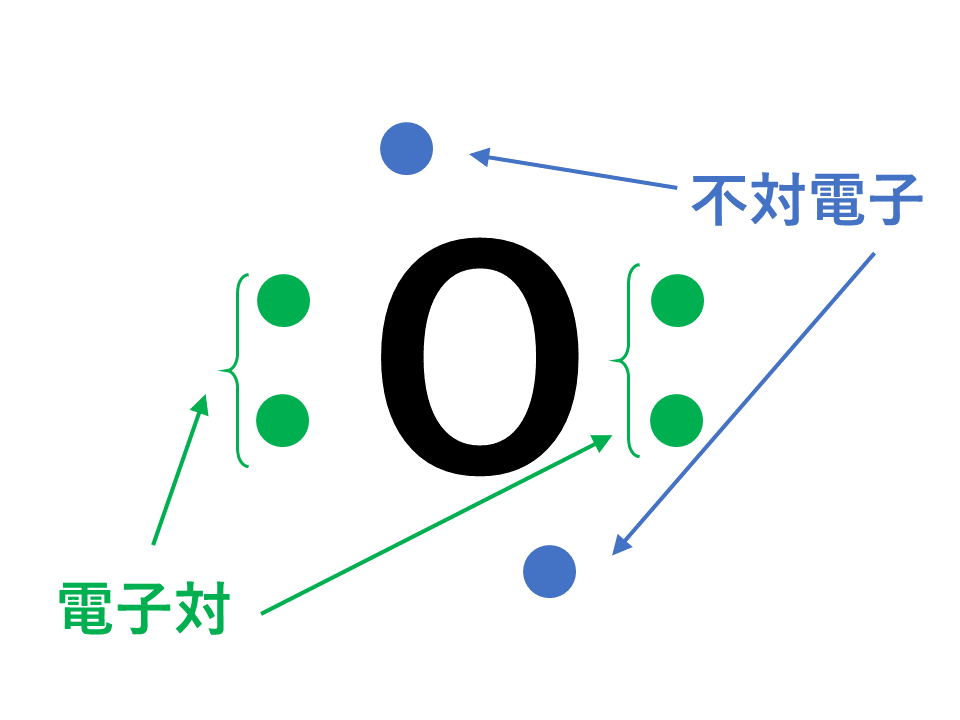
「最外殻電子」:共有している電子を「2個」と数える 「価電子」:共有している電子を「1個」と数える h o h h o h 「最外殻電子」 「価電子」 2個 8個 2個 1個 6個 1個 用途:オクテット則の判定 用途:総電子数の確認 12原子番号の増加にともなって価電子の数が周期的に変化する原因は、原子の電子配置と元素の性質が深く関わっている事が知られている。 原子価 化学を学ぶ上で欠かせないのが『周期表』である。 周期表を見れば、その原子が持つ『原子価の数』は直ぐ分かる。 ・原子価の数のルール/04/21 · 価電子数5つのうち、3つが不対電子となります。 例えば、アンモニアNH 3 の場合、不対電子3つと水素が共有結合し、3本の共有結合が生じます。 窒素原子Nからは、価標(棒線)が3本出



化学講座 第3回 元素の周期表 私立 国公立大学医学部に入ろう ドットコム




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ



化学講座 第3回 元素の周期表 私立 国公立大学医学部に入ろう ドットコム



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Electrons In The Outermost Shell




価電子数を求める方法 12 ステップ 画像あり Wikihow



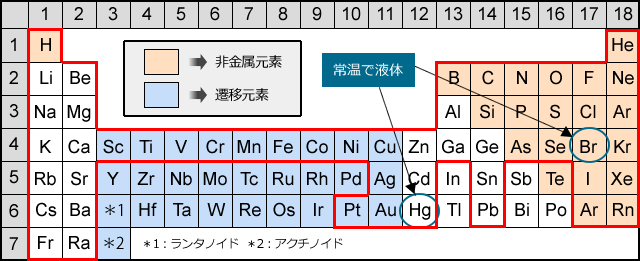
化学 はじめに 技術情報館 Sekigin 非金属元素の化学を紹介するうえで その背景 金属元素の定義による非金属元素の分類 及び典型元素の一般的特性などを紹介



化学重要問題集8 11 原子 イオン Tekibo



原子番号と価電子数 化学基礎 高校化学net参考書



3



5分でわかる 原子価の意味と一覧 価電子 価標の違い を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する




高校化学基礎 周期律と価電子 映像授業のtry It トライイット



バンドギャップ Wikipedia



Number 01 16 原子価 原子量 原子番号 Metatronic Metalogue



図解 電子配置の書き方の解説と電子配置の一覧 周期表 サイエンスストック 高校化学をアニメーションで理解する




ルイス構造 猫でもわかる有機化学




原子構造と電子配置 価電子 理系ラボ




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ




なぜヘリウムは電子の数か2個なのに価電子は0個なんですか なぜヘリ 高校 教えて Goo




電子式 イオン式から配位結合 錯イオンの仕組みまでわかりやすく解説




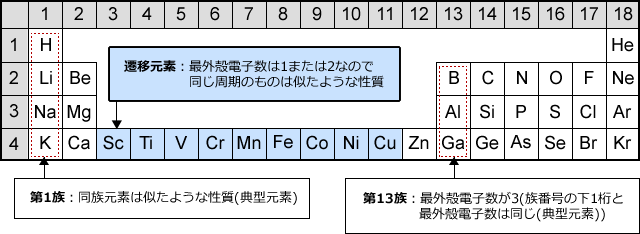
遷移元素の特徴 遷移元素のk殻 l殻 m殻 化学 By 藤山不二雄 マナペディア



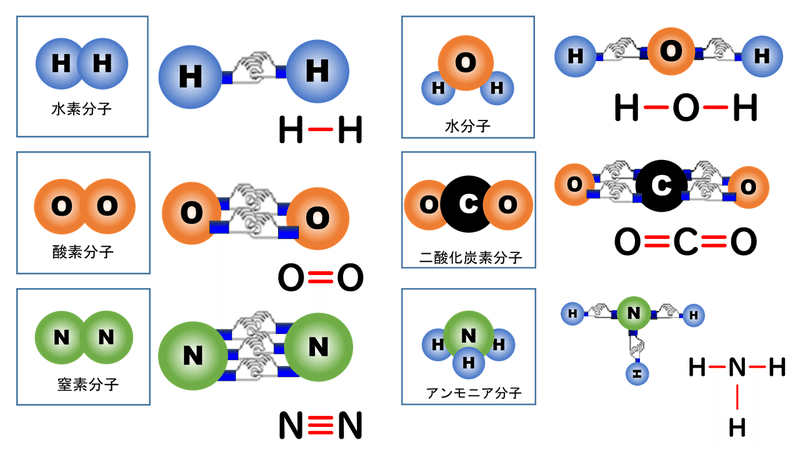
電子式の書き方と一覧 構造式と分子式の違い Vicolla Magazine



3 4 共有結合からなる物質 おのれー Note




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ




価電子 Chemihack おうちで学べる化学




高校化学基礎 原子価とは 映像授業のtry It トライイット




高校化学基礎 価電子とは 映像授業のtry It トライイット




電子式 イオン式から配位結合 錯イオンの仕組みまでわかりやすく解説




オクテット則 8電子則 大学化学講座




高校化学基礎 希ガスの電子配置 映像授業のtry It トライイット



イオン




環化 原子と元素 周期表 札幌カフェ部 活動報告




価電子とは 価電子数の数え方をやさしく説明するよ 授業 レベルa2 ともよし塾 受験と科学の解説授業



混成軌道



教養の化学 第5週 13年10月21日 担当 杉本昭子 Ppt Download




周期表 Wikipedia



アニメーション解説 電子式の書き方と一覧 構造式と分子式の違い サイエンスストック 高校化学をアニメーションで理解する



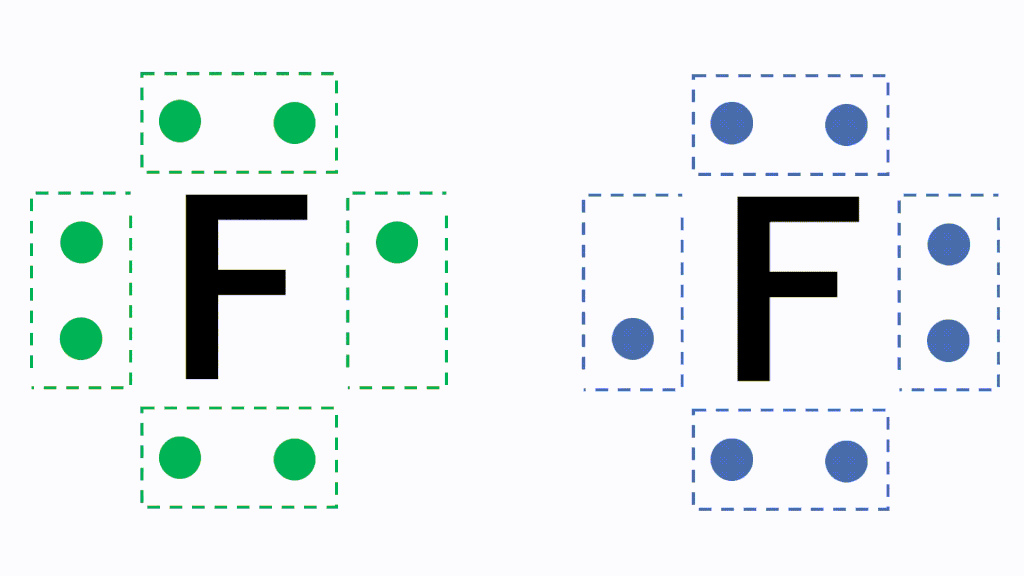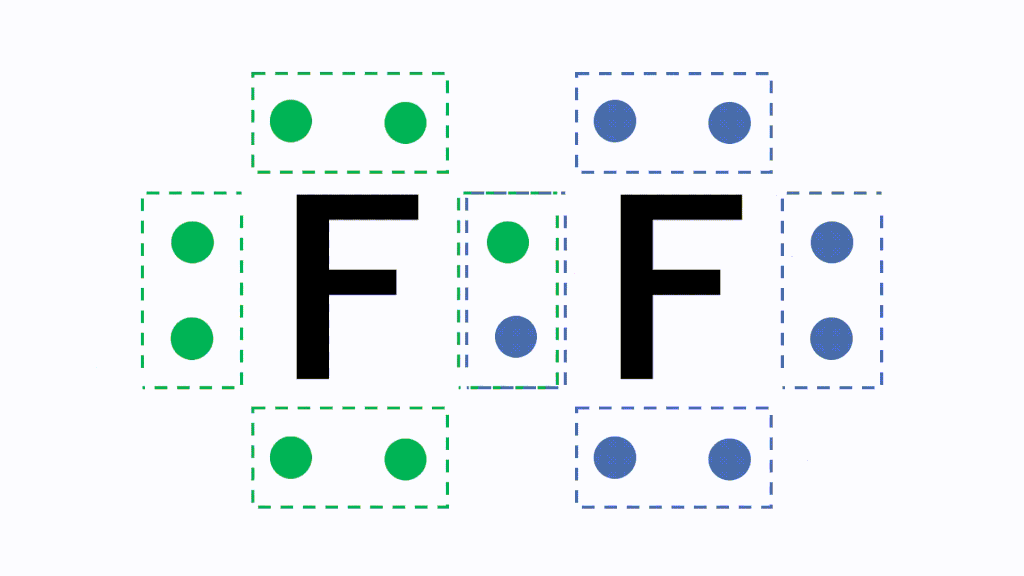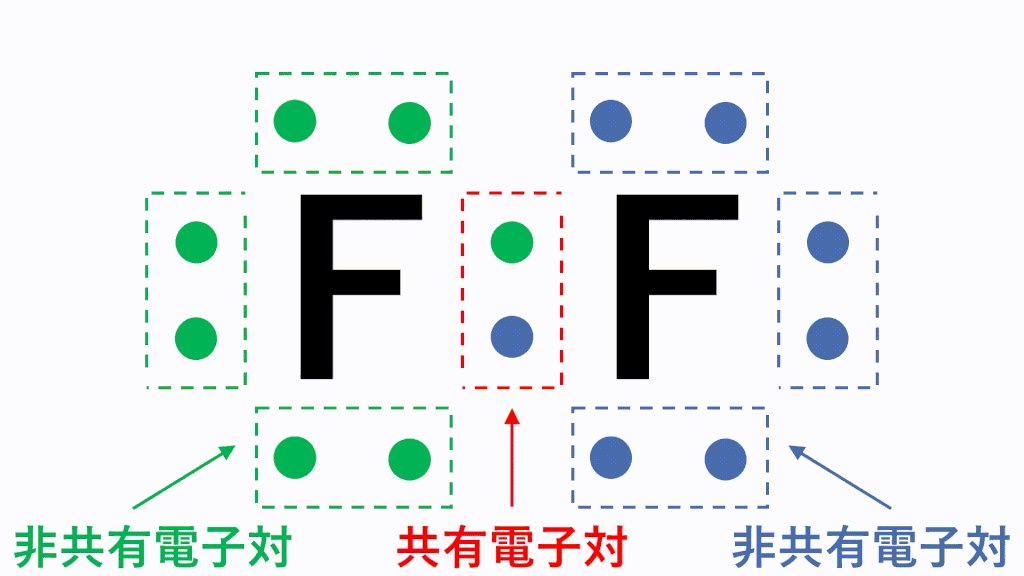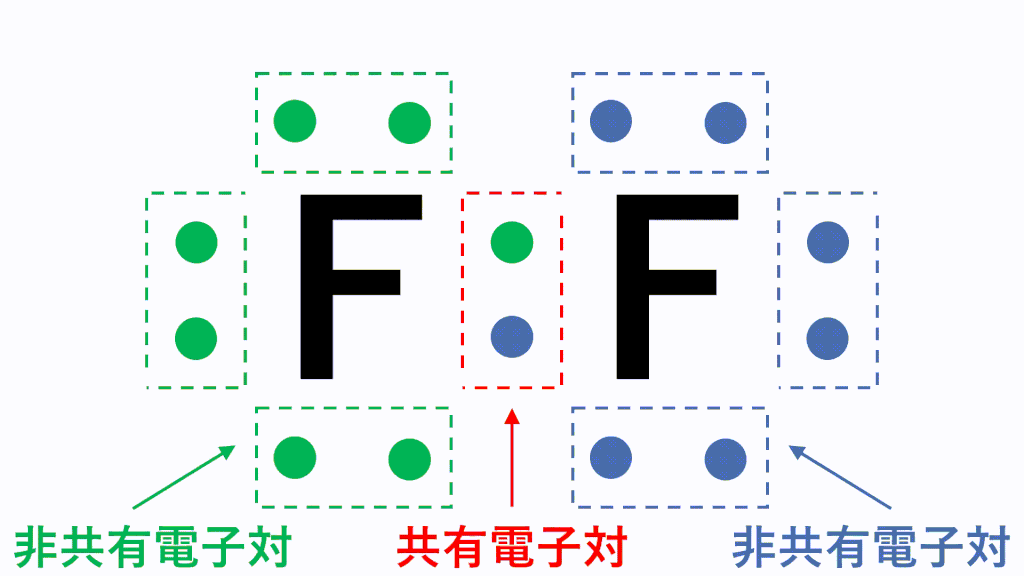
価電子とは 数え方や覚え方 最外殻電子との違いは




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ



Q Tbn And9gcsehw5cwcaw6di4o3vedvsm7lzfqsols7n4fsxrmqq C2oljibh Usqp Cau




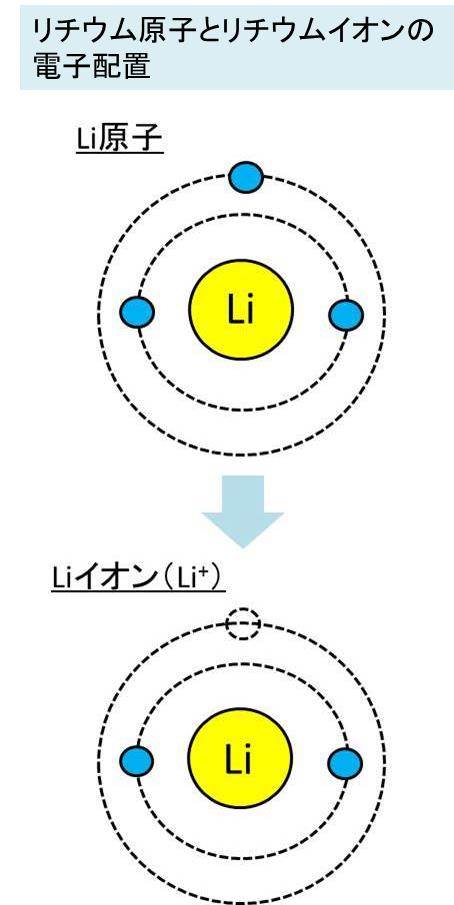
価電子数と同じ電子配置の希ガス原子をどう求めるのかわかりません Clear
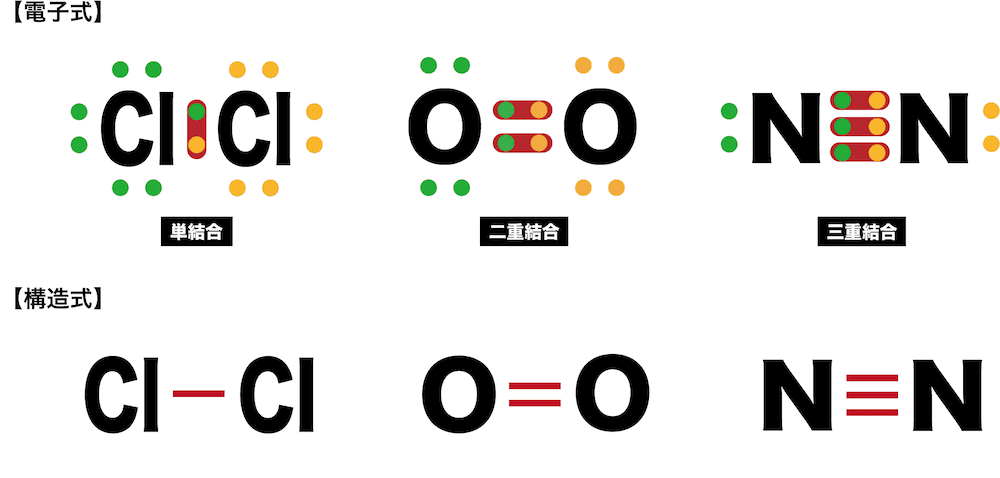



共有結合 例 イオン結合や配位結合との違いなど 化学のグルメ



Q Tbn And9gcsehw5cwcaw6di4o3vedvsm7lzfqsols7n4fsxrmqq C2oljibh Usqp Cau



化学基礎 最外殻電子と価電子 Youtube



化学講座 第3回 元素の周期表 私立 国公立大学医学部に入ろう ドットコム



化学講座 第4回 第一イオン化エネルギーと第nイオン化エネルギー 私立 国公立大学医学部に入ろう ドットコム



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Mat3 Pdf



4 原子の基本的性質



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Mat3 Pdf



1 4 電子殻と電子配置 おのれー Note




化学結合とは コトバンク



原子価の意味と一覧 価電子 価標の違い Vicolla Magazine



理論 電子配置と電子軌道 受験 定期テストで高校化学を完全攻略



1



Http Heian Gacco Que Jp Haitisyuukikaitou Pdf



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Mat3 Pdf




遷移元素 Wikipedia



化学講座 第2回 原子のつくり その 2 私立 国公立大学医学部に入ろう ドットコム



Http Heian Gacco Que Jp Haitisyuukikaitou Pdf




最外殻電子と価電子の違いは 化学受験テクニック塾




高校化学基礎 元素の周期表 映像授業のtry It トライイット




化学基礎 物質の構成 価電子 10分 Youtube




原子価の意味と一覧 価電子 価標の違い Vicolla Magazine




高校化学 電子配置 最外殻電子 オンライン無料塾 ターンナップ Youtube




価電子とは 価電子数の数え方をやさしく説明するよ 授業 レベルa2 ともよし塾 受験と科学の解説授業




価電子数と同じ電子配置の希ガス原子をどう求めるのかわかりません Clear



Www Nhk Or Jp Kokokoza Tv Kagakukiso Archive 21kagakukiso 08 Pdf
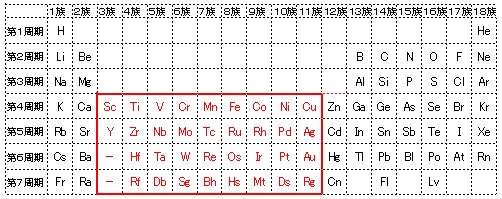



価電子 Valence Electron Japaneseclass Jp



原子 の 電子 配置 第2周期元素の電子配置についてのまとめ 有機化学でも無機化学でも重要な頻出元素の特徴を押さえる
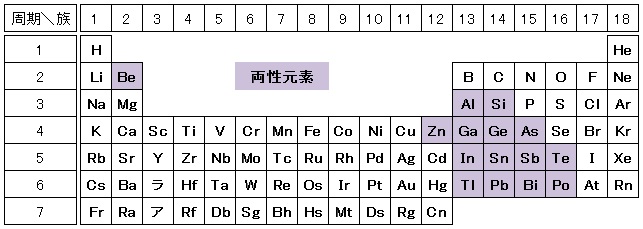



元素の分類 化学基礎 高校化学net参考書
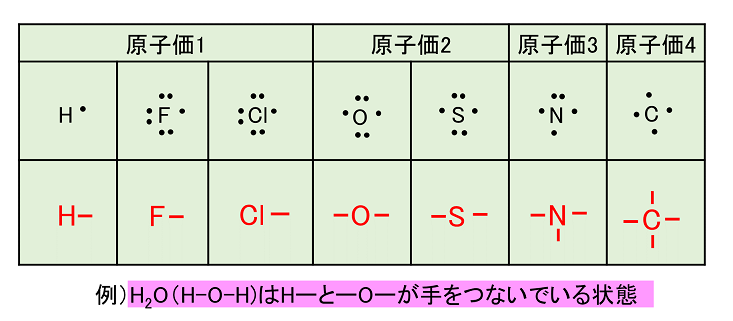



分子と共有結合




受験生 高校生必見 周期表の覚え方 スイヘーリーベだけじゃナンセンス めんまのつぶやき



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Mat3 Pdf



価電子 Chemihack おうちで学べる化学
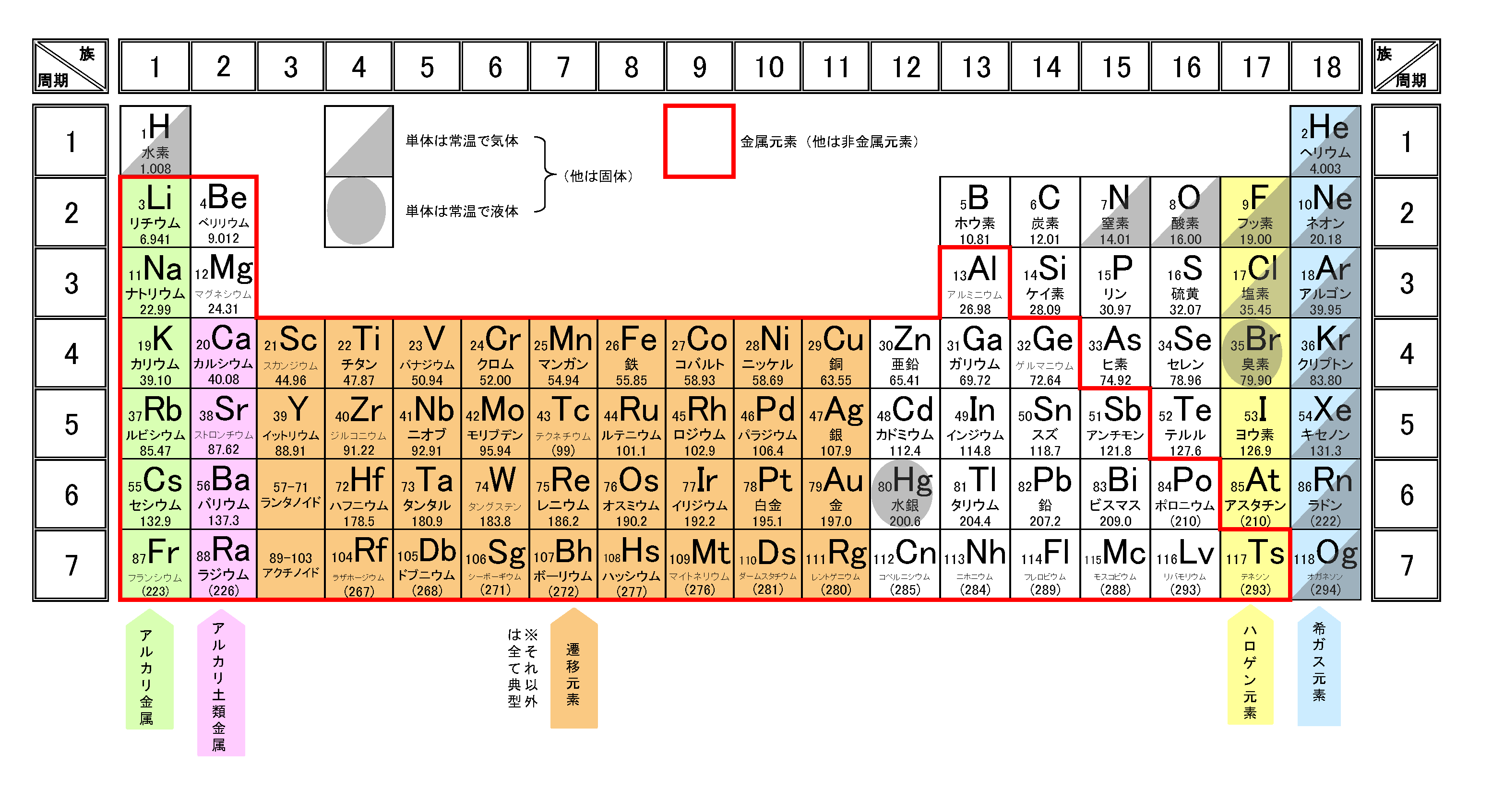



完全版 周期表の語呂合わせの覚え方と族 縦 や周期 横 の見方 サイエンスストック 高校化学をアニメーションで理解する



アクチノイドとは コトバンク



Http Www Sc Fukuoka U Ac Jp Ic Text Gairon Pdf



非金属 水浄化フォーラム 科学と技術
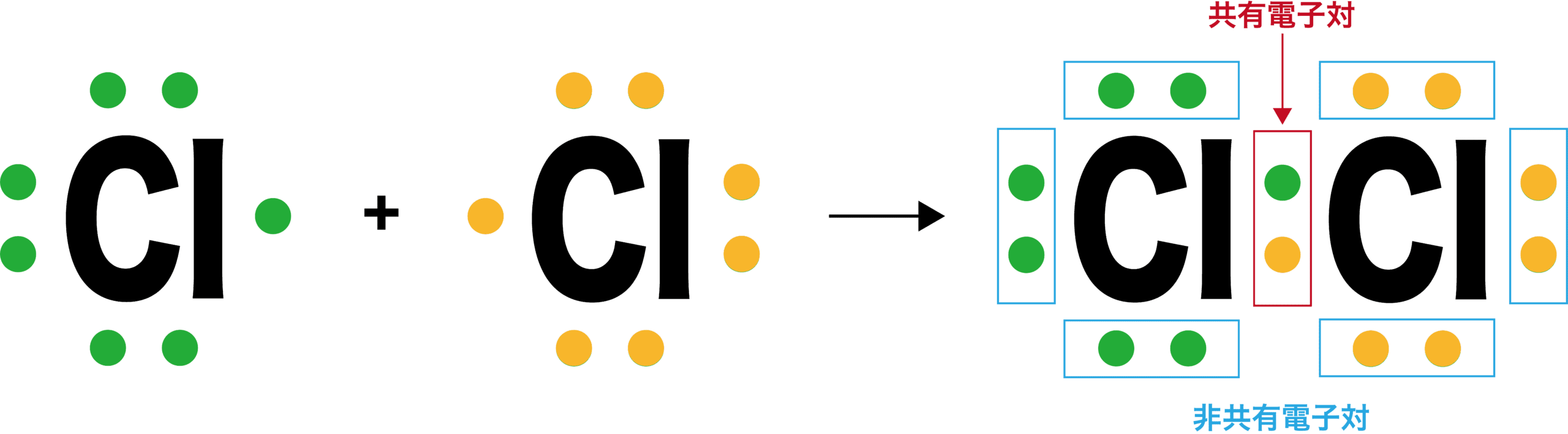



電子式 書き方 ルール 一覧 演習問題など 化学のグルメ



Www Pen Kanagawa Ed Jp Y Meiho H Oshirase Documents 2 Kagakukiso 0605 Pdf




遷移元素 Wikipedia




原子構造と電子配置 価電子 理系ラボ



Http Oec Chembio Nagoya U Ac Jp Pdfs 17 Orgmet 01 Handout Pdf
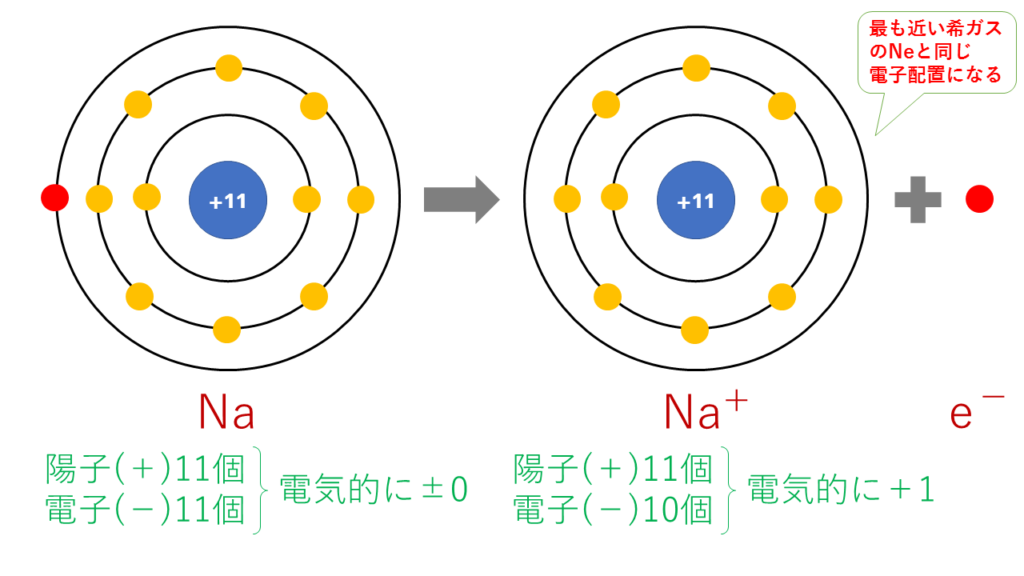



5分でわかる 陽イオン 陰イオン 単原子イオン の価数の考え方と覚え方 電子配置を図で解説 サイエンスストック 高校化学をアニメーションで理解する



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Electron Configuration Denshi



1 4 電子殻と電子配置 おのれー Note




高校化学基礎 周期律と価電子 映像授業のtry It トライイット




どうしてk カリウム の最外殻電子の数は1になるのですか 教えてください Clear




原子構造と電子配置 価電子 理系ラボ



価電子とは 数え方や覚え方 最外殻電子との違いは



Number 01 16 原子価 原子量 原子番号 Metatronic Metalogue




周期表で縦に並ぶ 同族元素 を元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン



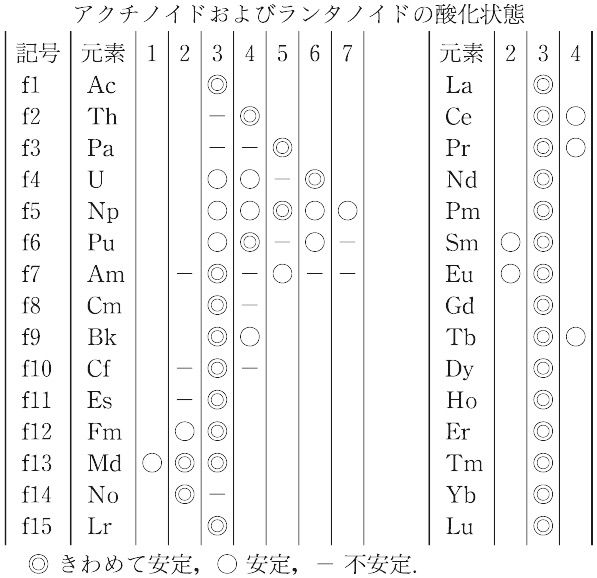
研究解説 希土類元素の物理化学 その2


コメント
コメントを投稿